27 nov 2024
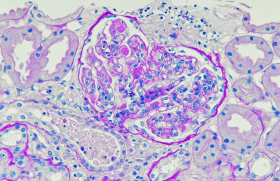
Traitement de la néphropathie à IgA, la révolution est en marche
Simon VILLE, CHU de Nantes
Lors de la Kidney Week qui s’est tenu à San Diego du 24 au 27 octobre, les résultats de nombreux essais randomisés concernant la néphropathie à IgA ont été dévoilés et publiés simultanément dans le New England Journal of Medicine et le Journal of the American Society of Nephrology, confirmant que ce domaine est en train d’évoluer très rapidement.
Jusqu’à peu, les néphrologues ne disposaient d’aucun moyen autre que les bloqueurs du SRAA pour traiter leurs patients atteints de cette maladie décrite par Jean Berger en 1968. Alors que des traitements immunosuppresseurs/immunomodulateurs ont montré une efficacité dans toutes les autres glomérulonéphrites (GN), la plus fréquente d’entre elle résistait encore. En effet les quelques molécules utilisées jusqu’à présent pour traiter les GN, n’ont pas montré d’efficacité dans cette indication, ou du moins, en particulier pour la corticothérapie, pas avec une balance bénéfice risque suffisante.
Les progrès actuels s’expliquent bien sûr par l’émergence de nouvelles molécules, mais aussi en grande partie par une optimisation de leur programme de développement clinique. Jusqu’à présent les essais cliniques dans la néphropathie à IgA s’en tenaient à des critères de jugement durs, nécessitant une durée de suivi longue, du fait de son évolution subaiguë. En 2019, partant de ce constat, et en se basant sur les données des essais antérieurs, la société américaine de néphrologie (ASN) et les instances régulatrices (FDA puis l’EMA), groupées au sein de la Kidney Health Initiative (KHI) ont établi qu’une molécule ayant un effet sur la protéinurie à 36 semaines, dorénavant considérée comme le « surrogate endpoint » de référence, méritait d’entrer dans une procédure accélérée, aboutissant à son autorisation de mise sur le marché sous réserve d’une efficacité sur la pente de décroissance du DFGe à 104 semaines, établie comme critère de jugement confirmatoire.
Jusqu’à présent deux molécules ont passé ces deux étapes et devraient donc être rapidement disponible, le sparsantan un antagoniste des récepteurs de l’endothéline (ERA) ayant la particularité d’être aussi un ARAII, et le nefecon une forme particulière de budésonide, c’est-à-dire un corticostéroïde qui agit au niveau de la muqueuse digestive avec un faible passage systémique.
À la Kidney Week et donc dans le NEJM (https://www.nejm.org/doi/full/10.1056/NEJMoa2409415), les résultats positifs de 2 études de phase III ayant atteint la première étape (l’évaluation de la protéinurie à 36 semaines) ont été révélés. La première molécule est l’atrasentan un ERA dit sélectif (sans activité ARAII), avec une baisse de la protéinurie de 38 % contre 3 % dans le bras placebo soit une différence de 36 % (n = 135 dans chaque groupe) et avec un profil de tolérance similaire (11,2 % de rétention hydrosodée avec l’atrasentan). De plus dans cet essai des résultats similaires étaient observés chez 29 patients précédemment traités par un SGLT2 inhibiteur (une molécule déjà considérée comme requise dans le traitement de la néphropathie à IgA sur la base d’analyse secondaire de DAPA et d’EMPA-CKD). Dans le cas de la seconde molécule il s’agit d’un « first-in-class », en effet l’iptacopan est un anti-facteur B, le rationnel étant de s’opposer à l’activation supposée délétère du complément en aval des dépôts d’IgA dans le glomérule. Cette fois la différence à 36 semaines entre les 125 patients de chaque groupe était de 38 % (avec également une trentaine de patients préalablement traités par iSGLT2), et avec une très bonne tolérance. Ces deux études vont donc se poursuivre pour juger de l’efficacité de ces molécules sur le critère de jugement confirmatoire (la pente du DFG à 104 semaines).
Dans le JASN, ce sont des résultats plus préliminaires qui ont été publiés, à savoir ceux de phases 2 dont l’objectif est de déterminer la dose efficace qui serait, en cas de résultats favorables, celle utilisée dans une future phase 3. Ils concernent un autre ERA sélectif (le SC0062, https://journals.lww.com/jasn/fulltext/9900/the_selective_endothelin_receptor_antagonist.459.aspx) avec une différence de 51 % sur la protéinurie à 24 semaines avec la dose la plus élevée, et un autre anti-complément, le ravulizumab un anti-C5, à la posologie déjà utilisée dans le traitement du SHU atypique pour lequel une baisse de 30 % était observée à la semaine 26. La dernière étude publiée dans JASN est aussi une phase 2 avec recherche de dose mais qui avait déjà été publiée, cette nouvelle publication concerne la phase d’extension qui était proposée à tous les patients avec la plus forte posologie au terme de l’étude (après la semaine 36) jusqu’à la semaine 96. Cette fois, il s’agit de l’abatacept une protéine de fusion qui bloque à la fois BAFF et APRIL des facteurs de survie des lymphocytes B à leur différents stades de développement. Le rationnel est donc ici d’agir bien en amont, sur la synthèse des IgA1 qui sont à l’origine de la maladie. Ce qui est mis en avant par les auteurs au-delà de la baisse de la protéinurie (-52 %), c’est la pente de décroissance du DFGe qui est de -0,6 ± 0,5 mL/min/1,73 m2 par an, soit proche de ce qui est observé dans la population générale.
Les résultats positifs de la phase 2 d’un anti-APRIL « simple », le sibeprenlimab avaient aussi été publiés en 2024 dans le NEJM (Mathur M et al. N Engl J Med 2024 ; 390 : 20-31) et les résultats d’une phase 3 en cours sont attendus. Au-delà des phases 2 et 3 sont en cours avec d’autres molécules ciblant APRIL (Bion 1301) +/- BAFF (povetacicept) et également avec des molécules ciblant les plasmocytes (anti-CD38, felzartamab, mezagitamab). Enfin d’autres ont choisi de cibler la synthèse de certaines protéines du complément avec l’approche innovante des oligonucléotide anti-sense (ciblant le facteur B) ou des ARN interférent (cemdisiran ciblant le C5).
Nous sommes donc à l’aube d’une révolution dans la prise en charge des patients atteints de néphropathie à IgA, mais l’histoire est bien sûr loin d’être finie car l’accès à ces traitements va soulever un nombre considérable de questions quant à leur utilisation. Pour qui ? : intérêt de traiter des formes moins avancées ? Intérêt de cibler un mécanisme physiopathologique particulier en fonction du profil du patient ? Quid des formes secondaires ? Des patients transplantés ? ; Quand/Comment ? : traitement continu ? séquentiel ? association de molécules entres elles ?
Plutôt que des essais menés par l’industrie, à l’image de ceux en cours, les réponses à ces questions viendront plus vraisemblablement d’initiatives académiques et/ou d’une analyse rigoureuse des données de vraie vie, pour lesquelles des collaborations à grandes échelle seront nécessaires.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :